2,2 Millionen Euro für Brenda Schulman
Direktorin am Max-Planck-Institut für Biochemie erhält den ERC Advanced Grant für ihre aktuelle Forschung
Juli 2018
© Max-Planck-Institut für Biochemie
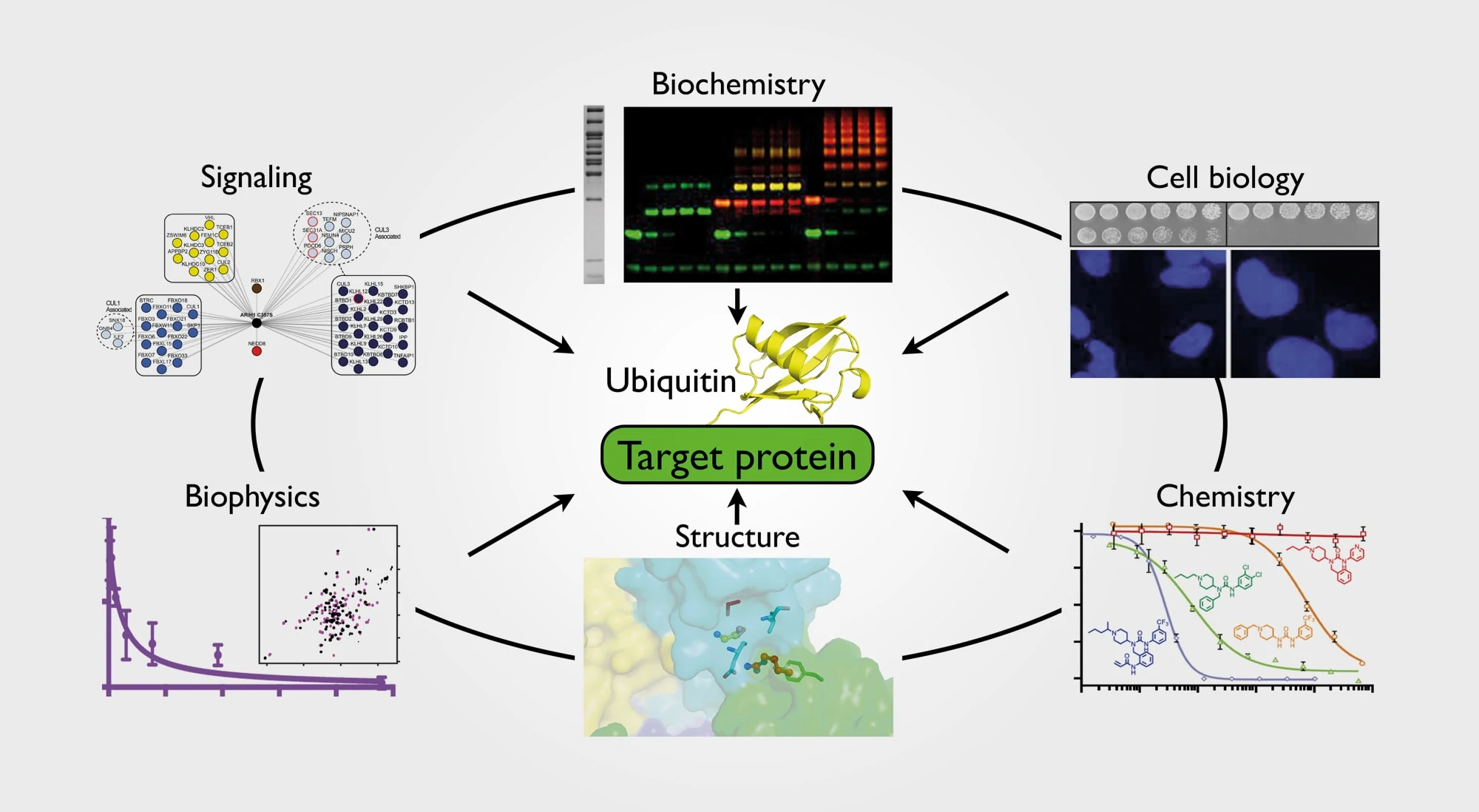
Prof. Schulmans Abteilung arbeitet interdisziplinär, wobei Methoden der Zellbiologie, Biochemie, Genetik, Chemie, Strukturbiologie und Biophysik mit einbezogen werden, um zu verstehen, wie Proteine durch ubiquitinähnliche Proteine und Ubiquitin an- oder abgeschaltet werden
Seit 2017 leitet Brenda Schulman, Ph.D., die Abteilung „Molekulare Maschinen und Signalwege“ am Max-Planck-Institut für Biochemie in Martinsried bei München. Sie erhielt zahlreiche Auszeichnungen, darunter den USA Presidential Early Career Award for Scientists and Engineers. Sie ist Mitglied der American Academy of Arts and Sciences und der National Academy of Sciences. Jetzt erhielt die Direktorin am Max-Planck-Institut für Biochemie in Martinsried und Leiterin der Abteilung „Molekulare Maschinen und Signalwege“ den ERC Advanced Grant des Europäischen Forschungsrates (ERC). Über einen Zeitraum von fünf Jahren bekommt Schulman rund 2,2 Millionen Euro für ihre Forschung.
Schulman studierte Biologie an der Johns Hopkins University, Baltimore, MD, USA. Nach ihrer Promotion am M.I.T., Cambride, MA, USA, im Jahr 1996 arbeitete sie als Postdoc am Massachusetts General Hospital Cancer Center, Boston, MA, USA und am Memorial Sloan-Kettering Cancer Center, New York, NW, USA. 2001 wechselte Schulman an das St. Jude Children‘s Research Hospital in Memphis, TN, USA und war hier von 2005 bis 2017 am Howard Hughes Medical Institute tätig.
Gemeinsam mit ihrem Team untersucht Schulman vorwiegend Mechanismen, die für die Regulation zellulärer Proteine verantwortlich sind. Proteine sind die Arbeitspferde der Zellen. Unterschiedliche Funktionen werden von verschiedensten Proteinklassen wahrgenommen, von Enzymen, die Nahrung verdauen, bis hin zu Proteinen, die Bestandteile der Muskeln sind. Um ihre Arbeit ordnungsgemäß erfüllen zu können, müssen sie bei Bedarf angeschaltet oder deaktiviert werden, wenn ihre Arbeit erfüllt ist. Einer der Wege, wie Proteine abgeschaltet werden, ist, sie mit einem anderen kleinen Protein zu markieren, dem sogenannten Ubiquitin. Ebenso wie es eine Vielzahl von Proteinen in der Zelle gibt, gibt es hunderte kleine molekulare Maschinen, die E3-Ligasen, die für die Markierung der unterschiedlichen Proteine verantwortlich sind. Es ist deshalb essentiell, dass die E3-Ligasen selbst in der Zelle zur richtigen Zeit und am richtigen Ort an- oder abgeschaltet werden.

Brenda Schulman, Ph.D., Direktorin am Max-Planck-Institut für Biochemie
© Max-Planck-Institut für Biochemie
Der „Anschalter“ für circa ein Drittel aller E3-Ligasen ist ein kleines Protein, das dem Ubiquitin sehr ähnlich ist, aber NEDD8 genannt wird. „Obwohl wir die einzelnen Bausteine vieler E3-Ligasen kennen, wissen wir nicht, wie NEDD8 diese zum richtigen Zeitpunkt und am richtigen Ort zusammenführt oder wie NEDD8 sie dazu bringt, Ubiquitin auf Proteine zu übertragen, die markiert werden müssen“, sagt Schulman. „Unter Anwendung multidisziplinärer Ansätze versuchen Wissenschaftler alle Details zu verstehen, wie NEDD8 E3-Ligasen aktiviert, die Mechanismen der aktivierten Ubiquitin Ligase Maschinen und wie aktivierte E3-Ligasen andere Proteine deaktivieren, die wiederum abgeschaltet werden müssen“, fasst Schulman zusammen.
„Letztendlich wollen wir das so detailliert darstellen wie in einem 3D-Film. Wir wollen die einzelnen Schritte in drei Dimensionen visualisieren, indem wir elektronenmikroskopische Bilder verwenden. Wir setzen dann die 3D-Fotos ein, um die dynamischen Schritt-für-Schritt-Wege zu verstehen, wie NEDD8 spezifische E3-Ligasen aktiviert und wie die aktivierten E3-Ligasen bestimmte Proteine ausschalten“, so Schulman. Sie erwartet, dass die Entdeckung der zahlreichen Möglichkeiten, wie NEDD8 viele verschiedene aber verwandte E3-Ligase-Maschinerien aktiviert, eine Vielzahl verschiedener biologischer Prozesse erklären wird, z.B. Immunität, Proliferation von Krebszellen, Infektionen durch Viren, wann wir aufwachen und schlafen, und sogar das Wachstum von Pflanzen.
- Am Klopferspitz 18
- 82152 Martinsried
- Tel.: +49 (89) 8578 – 0
- ed.gpm.mehcoib@rp
- www.biochem.mpg.de



